本站消息 10月8日,学校中药材科研团队以“Mechanistic Insights Into Functional Innovations of Dammarenediol-II Synthase in Panax ginseng” 为题在知名国际期刊Plant Biotechnology Journal(中科院1区TOP,影响因子10.5)发表最新研究成果,该研究首次阐明人参达玛烯二醇合酶(DDS)为何专一合成四环达玛烯二醇(DM-II),而同类酶β-香树脂醇合酶(β-AS)却只生成五环β-amyrin的分子机制。
三萜类化合物是植物中结构最多样、功能最丰富的次生代谢产物之一。其中,三萜皂苷作为三萜的重要衍生物,因其显著的生物活性和结构复杂性,成为天然药物研究与开发的热点。三萜皂苷的复杂性源于三个关键层次的酶促反应:上游甲羟戊酸(MVA)途径提供通用前体;中游的氧化鲨烯环化酶(OSCs)催化共同前体2,3-氧化鲨烯(OS)环化生成结构各异的三萜骨架;下游的细胞色素P450单加氧酶(CYPs)和尿苷二磷酸糖基转移酶(UGTs) 则对骨架进行氧化和糖基化修饰。OSCs环化生成结构各异的三萜骨架是四环与五环三萜多样性产生的根源。
β-香树脂醇和达玛烯二醇是人参五环三萜和四环三萜的基础骨架。其中,β-香树脂醇合酶(β-AS)和达玛烯二醇合酶(DDS)均以OS为底物,共享达玛烯阳离子中间体,却分别催化生成五环β-香树脂醇和四环达玛二烯醇-II(DM-II),展现出显著的产物特异性。然而,控制这一特异性的分子机制仍属未知。研究从NCBI筛选39条DDS-like基因,系统发育分析显示DDS与β-AS各自成簇。酵母异源表达表明22条基因产DM-II,无β-amyrin。多序列比对锁定8个单功能组保守位点,其中PgOSCPNY1的M240为关键残基。将该位点突变为DDS特征性亮氨酸(M240L)后,β-AS获得合成DM-II能力,但产量极低。团队继续构建M2–M8系列组合突变,DM-II产量随突变数增加而提高,M8突变体产量达到野生型DDS(PgPNA)的46.45%。
反向实验中,将PgPNA的L242突变为甲硫氨酸(L242M)可检测微量 β-amyrin;引入 M8 组合突变后,β-amyrin产量提高149.51%。分子动力学模拟显示,人参β-AS中L251、M253、L325造成“U”型构象,促进达玛烯基阳离子 D 环扩张,生成β-amyrin;人参DDS中对应残基 F253、F255、V327引导“V”型构象,抑制D环扩张,水合后生成DM-II。预组织始于底物通道,M240/L242 的空间位阻进一步细化构象。
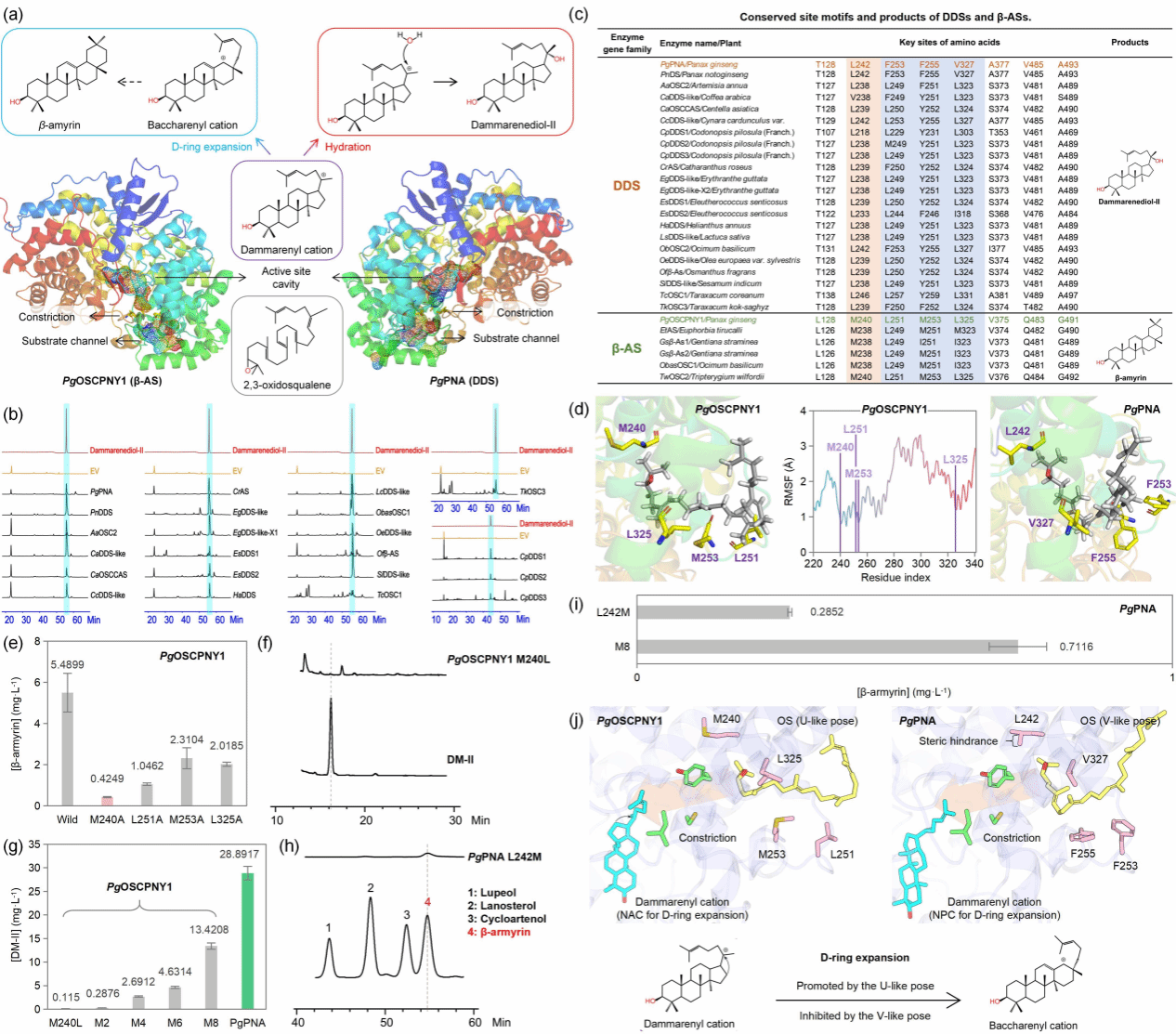
跨物种比对发现,刺五加DDS虽具备M240L及稳定性突变 L128T/Q483V/G491A,但缺少“V”型构象模块,酶活显著低于人参属,证实该模块对高效合成DM-II不可或缺。T128、L242、V485、A493在不同植物DDS中高度保守,揭示了DDSs中存在的趋同进化;独特的“V型”基序则代表了人参属的谱系特异性创新。研究表明人参DDS的功能创新源于β-AS四个关键位点的协同突变:通过重塑底物预组织构象调控产物选择性,其余位点突变影响酶稳定性。该研究结果为三萜合成生物学与酶工程提供了可操作的改造位点。
农学与生物技术学院博士研究生冯垒为第一作者,赵艳教授、硕士研究生付冬菊为共同第一作者,杨生超教授、张广辉教授、范源洪研究员为共同通讯作者。本研究获云南特色植物提取实验室(2022YKZY001; 2022YKZY004)、云南种子实验室(202205AR070001; 202305AR340004)、云南省重大科技专项(202102AA310048; 202502AU100003)、兴滇英才支持计划(XDYC-YLXZ-2022-0032)等项目资助。
论文链接:https://doi.org/10.1111/pbi.70299
